与欧美相比,我国在生物类似药方面发展较晚。2015年2月,国家食品药品监督管理总局(CFDA)正式发布的《生物类似药研发与评价技术指导原则(试行)》(以下简称指导原则),以及随后对该指导原则进行的研讨解读,促进了我国制药企业加快生物类似药的开发。本文将对国内主要生物类似药的开发情况进行统计及分析。
阿达木单抗
阿达木单抗(Adalimumab)是一种抗肿瘤坏死因子a(TNFa)的全人源单克隆抗体药物,由Abbvie公司研发,于2010获得CFDA批准在国内上市。阿达木单抗能与TNFa结合,中和TNFa的生理活性而发挥抗炎作用。该药国内批准的适应证为:成年中重度活动性类风湿性关节炎、重度活动性强直性脊柱炎。
目前,国内众多药企正在进行阿达木单抗的“仿制”开发,获得该品种临床批件的企业有百奥泰生物、康宁杰瑞、复宏汉霖、海正药业、信达生物和众合医药,另外有10多家企业的该药仿制药已申报临床试验。
英夫利昔单抗
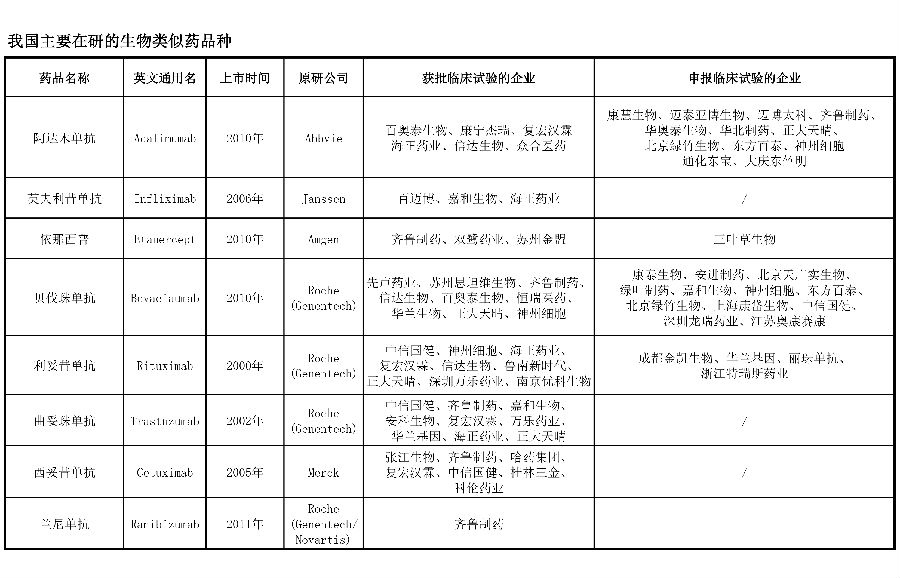
英夫利昔单抗(Infliximab)是一种抗TNFa的人鼠嵌合型单克隆抗体药物,由Janssen公司研发,于2006年获得CFDA批准在国内上市。该药物通过与TNFa结合,中和TNFa的生理活性而发挥抗炎作用。该药国内获批的适应证为:类风湿性关节炎、克罗恩病、强直性脊柱炎、牛皮癣关节炎、溃疡性结肠炎。
截至目前,获得该品种临床批件的企业有百迈博、嘉和生物和海正药业。
依那西普
依那西普(Etanercept)是重组人TNF受体和人IgG-Fc的融合蛋白药物,由Amgen公司研发,于2010年获得CFDA批准在国内上市。该药通过中和TNFa的体内活性而发挥抗炎作用,国内获批的适应证为:类风湿性关节炎和强直性脊柱炎。
在指导原则发布之前,中信国健的益赛普、赛金生物的强克、海正药业的安佰诺分别以新药形式,于2005年、2011年和2015年获批上市。截至目前,获得该品种临床试验批件的企业有齐鲁制药、双鹭药业和苏州金盟,三叶草生物已申报临床试验。
贝伐珠单抗
贝伐珠单抗(Bevacizumab)是一种抗血管内皮生长因子(VEGF)的人源化单克隆抗体药物,由Roche公司旗下的Genentech公司研发,于2010年获得CFDA批准在国内上市。该药通过抑制VEGF与其位于内皮细胞上的受体相结合,使VEGF失去生物活性而减少肿瘤的血管形成,从而抑制肿瘤的生长。贝伐珠单抗在国内获批的适应证为:转移性结直肠癌、非小细胞肺癌。
截至目前,获得该品种临床试验批件的企业为先声药业、苏州思坦维生物、齐鲁制药、信达生物、百奥泰生物、恒瑞医药、华兰生物、正大天晴和神州细胞,另有10多家企业已申报该品种的临床试验。
利妥昔单抗
利妥昔单抗(Rituximab)为一种抗CD20的人鼠嵌合性单克隆抗体药物,由Roche公司旗下的Genentech公司研发,于2000年获得CFDA批准在国内上市。该抗体与B淋巴细胞表面CD20抗原特异性结合,通过补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC)机制,引起B细胞溶解。该药国内获批的适应证为:非霍奇金淋巴瘤。
截至目前,获得该品种临床试验批件的企业有中信国健、神州细胞、海正药业、复宏汉霖、信达生物、鲁南新时代、正大天晴、深圳万乐药业和南京优科生物,另外有数家企业已申报临床试验。
曲妥珠单抗
曲妥珠单抗(Trastuzumab),是抗人表皮生长因子受体2(Her2)的人源化单克隆抗体药物,由Roche公司旗下的Genentech公司研发,于2002年获得CFDA批准在国内上市。该药通过与癌细胞表面过表达的Her2结合,阻止人体表皮生长因子在Her2上的附着,从而阻断癌细胞的生长,另外通过抗体依赖的细胞介导的细胞毒效应杀伤癌细胞。该药国内获批的适应证为:HER2过度表达的转移性乳腺癌、HER2过度表达的转移性胃腺癌或胃食管交界腺癌。
截至目前,获得该品种临床试验批件的企业有中信国健、齐鲁制药、嘉和生物、安科生物、复宏汉霖、万乐药业、华兰基因、海正药业和正大天晴。
西妥昔单抗
西妥昔单抗(Cetuximab)是抗表皮生长因子受体(EGFR)的人鼠嵌合抗体药物,由Merck公司研发,于2005获得CFDA批准在国内上市。该药与肿瘤细胞表面的EGFR特异性结合,阻断EGFR和其他配体如转化生长因子α(TGFα)的结合,通过对与EGFR结合的酪氨酸激酶的抑制作用,阻断细胞内信号转导途径,从而抑制肿瘤细胞的增殖,诱导肿瘤的凋亡。该药国内获批的适应证为:转移性结直肠癌。
截至目前,获得该品种临床试验批件的企业有张江生物、齐鲁药业、哈药集团、复宏汉霖、中信国健、桂林三金和科伦药业。
兰尼单抗
兰尼单抗(Ranibizumab)是抗VEGF单克隆抗体Fab片段药物,由Novartis公司和Roche公司旗下的Genentech公司共同研发,于2011年获得CFDA批准在国内上市。该药的作用机制为结合VEGF,从而减少内皮细胞的增生,阻止血管渗透和新生血管的形成,国内获批适应证为:湿性年龄相关性黄斑变性。
截至目前,获得该品种临床试验批件的企业为齐鲁制药,暂时没有新申报临床试验的企业。
点 评
2015年我国的生物药市场规模超过4000亿元人民币,销售品种主要以疫苗、血液制品和重组蛋白类为主。在CFDA发布指导原则之前,生物药品种均通过新药申报的方式获得CFDA批准上市,获批的主要为细胞因子、胰岛素和蛋白酶等结构简单的重组蛋白药物,尤其是细胞因子有多家企业生产销售,但单克隆抗体药物占比较小,并且与全球相比市场差距非常大。
随着“重磅炸弹”生物药专利的到期,且由于2015年CFDA发布了指导原则,越来越多的公司如复宏汉霖、齐鲁制药、海正药业、信达生物、嘉和生物、华兰基因和中信国健等加入到这些“重磅炸弹”产品的生物类似药的开发竞争之中。目前,在生物类似药的研发数量上我国已位居全球之首,未来国内生物类似药的市场竞争也将更加激烈。
从目前“重磅炸弹”产品的生物类似药的研发情况来看,除了兰尼单抗外,其余品种均有数家或者10多家企业获批临床试验,后续仍有企业处于申报临床试验或者临床前研究阶段,竞争非常激烈。同为TNFa靶点的抑制剂,阿达木单抗相对于依那西普和英夫利西单抗来说,除了还具有全人源化抗体的优势外,由于是预充针形式皮下注射液,具有使用方便的优势,所以国内对于“药王”阿达木单抗的“仿制”也最为疯狂,目前已有6家企业正在进行临床试验,10多家企业处于申报临床试验阶段,后续仍有多家企业处于临床前研究阶段。
对于兰尼单抗来说,由于同靶点的药物康柏西普已在国内上市,效果更优且价格大幅下降;同靶点的贝伐珠单抗以标签外用药形式用于治疗湿性年龄相关性黄斑变性等眼部疾病,而且价格非常低;同靶点的阿柏西普正在申请进口,疗效也优于兰尼单抗,所以对其“仿制”比较谨慎,目前只有齐鲁制药申报临床试验。
为了更好地支持国内生物类似药的发展,我国可以借鉴欧美的经验,完善相关政策和法规,从大环境上支持企业发展生物类似药。对于监管方来说,CFDA可以参考欧美的指导原则,出台指导细则,指导企业更快更好地开发生物类似药;由于生物类似药申报企业和申报品种数量众多,同一品种竞争非常激烈,还需合理引导企业“仿与创”结合,避免研发资源浪费。对于生物类似药开发企业来说,需要关注“仿制”品种及相关企业的竞争情况,根据企业自我定位,考虑国内市场容量及竞争情况,合理选择是定位国内还是着眼海外,提前进行项目设计与规划,选择适合自己的“仿制”品种和开发策略。
(选自《中国医药报》)