靶向药物的联合用药方案
抗肿瘤药在制药业是增长最迅速的领域。对于更有效安全性更好的抗肿瘤药的需求不断提高,由此驱动了新的联合用药方案的开发。一些包含两个或更多的靶向药物的联合方案已经获得批准,数量更多的联合方案也已进入后期临床开发阶段。
2012年6月,FDA批准了由两个HER2靶向药物—帕妥珠单抗(pertuzumab,Perjeta;罗氏)和曲妥珠单抗(赫塞汀;罗氏)组成的联合治疗方案,这也是第一个被批准的由多个靶向药物组成的联合方案。相比赫塞汀加多西他赛的联合方案,该方案使HER2阳性的转移性乳腺癌病人的总生存期延长了15.7个月。
第一个由BRAF抑制剂(dabrafenib;Tafinlar)和一个MAPK/ERK激酶(MEK)抑制剂(trametinib;Mekinist)组成的联合方案在2014年1月被FDA以加速审批的方式批准。该方案用于治疗无法切除或转移的BRAFV600E/K阳性黑色素瘤。两种药物都是由葛兰素史克公司开发并在2015年3月被诺华公司收购。该方案和BRAF抑制剂如dabrafenib或vemurafenib(Zelboraf;罗氏)单药治疗相比,诱发皮下鳞状细胞癌和角化棘皮瘤的风险更低。在2015年11月,由MEK抑制剂cobimetinib (Cotellic;Exelixis)和vemurafenib组成的联合方案获得FDA批准用于同一适应证。这或许会延缓vemurafenib在BRAFV600E/K黑色素瘤市场份额的流失。同时,也给了cobimetinib进入市场一个立足点。
2015年10月,FDA以加速审批方式批准了首个由免疫检查点抑制剂组成的联合方案,该方案包括程序性细胞死亡蛋白1抑制剂nivolumab(Opdivo;百时美施贵宝)和细胞毒T淋巴细胞抗原4(CTLA4)抑制剂ipilimumab(Yervoy;百时美施贵宝),用于治疗BRAFV600野生型无法切除或转移性黑色素瘤。批准是以一项名为CheckMate-069的II期临床试验为基础做出的。试验显示该联合方案显著优于ipilimumab单药方案,联合方案的总反应率是61%,完全反应率是22%,而单药治疗只取得11%的总反应率而无完全反应率。该联合方案的III期CheckMate-067试验总反应率数据还未公布,但和ipilimumab单药治疗相比,病情无进展生存期则显著延长(11.5个月Vs.2.9个月)。由于缺乏总反应率的III期临床试验数据,以及相对高的3级及4级不良反应发生率,该联合方案在近期内抢占市场份额还有一定难度。
在多发性骨髓瘤领域,由蛋白酶体抑制剂bortezomib(Velcade; Takeda/Millennium)或免疫调节剂lenalidomide(Revlimid;Celgene)和一种甾体激素或烷化剂组成的联合方案已在临床应用超过10年。而由上述药物和靶向药物组成的联合方案也在最近获得批准。2015年2月,由组蛋白脱酰基酶抑制剂panobinostat(Farydak;诺华)和bortezomib组成的联合方案获得FDA批准。而蛋白酶体抑制剂carfilzomib(Kyprolis;安进)和lenalidomide组成的联合方案也分别在2015年7月和11月获得FDA和欧洲医药管理局(EMA)的批准。而且,下一代的口服蛋白酶体抑制剂ixazomib(Ninlaro;武田/千年制药)和靶向信号淋巴细胞活化分子家族7(SLAMF7)免疫激活抗体elotuzumab (Empliciti;百时美施贵宝)和lenalidomide组成的联合方案均在2015年11月获得FDA批准。
许多处于临床开发阶段的联合方案都涉及到免疫检查点抑制剂如ipilimumab, nivolumab和pembrolizumab(Keytruda;默克)。由nivolumab和ipilimumab组成的联合方案正处于治疗非小细胞肺癌,小细胞肺癌,头颈部鳞状细胞癌以及肾癌的III期临床试验。
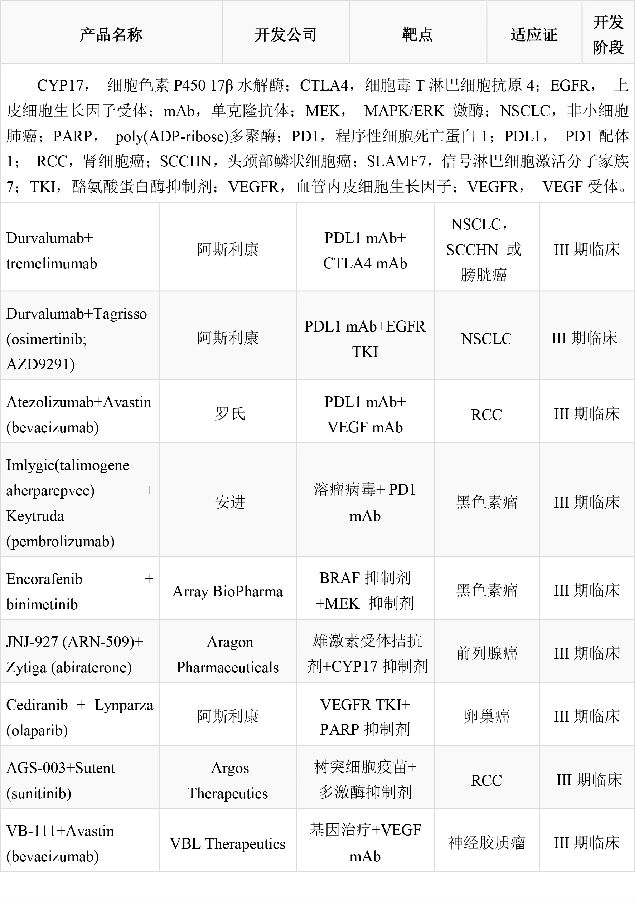
由程序性细胞死亡蛋白1配体1(PDL1)靶向药物durvalumab(阿斯利康)和CTLA4靶向单抗药物tremelimumab(阿斯利康)组成的联合方案正在进行6项III期临床试验,分别针对非小细胞肺癌,头颈鳞状细胞癌和膀胱癌。Durvalumab单药治疗非小细胞肺癌和头颈鳞状细胞癌的I期临床数据看起来很有前景。但目前还没有tremelimumab单药或联合方案治疗头颈鳞状细胞癌的数据。两种药,无论是单独使用还是联合应用,都没有治疗膀胱癌方面的数据。Durvalumab与阿斯利康公司的osimertinib (Tagrisso)治疗上皮细胞生长因子受体T790M突变阳性的转移性非小细胞肺癌的试验也已开展。但III期试验(CAURAL试验)和Ib期试验(TATTON)都已暂停,因为接受联合接受的病人有更大风险发生间质性肺病。一项名为IMmotion151的III期临床试验用于评价抗-PDL1抗体atezolizumab(罗氏)和抗血管生成药物贝伐单抗(Avastin;罗氏)联合应用相比较靶向药物(如多激酶抑制剂sunitinib(Sutent;辉瑞))单独使用治疗转移性肾细胞癌的效果。如果该联合方案获得批准将影响sunitinib在该适应症的领先地位并有助于重振贝伐单抗的市场地位。
首个溶瘤病毒治疗药物talimogene laherparepvec(Imlygic;安进)在2015年获得FDA批准用于治疗已接受手术切除但复发的黑色素瘤病人。在名为OPTiM的III期临床试验中,和粒细胞-巨噬细胞集落刺激因子相比,接受该药治疗的患者有更高比例获得持续反应(16.3% Vs.2.1%)。但提高总生存期和改善内脏转移方面,该药并没有显示统计学显著性提高。该新型药物也有潜力成为联合方案的组成成分,与几个免疫检查点抑制剂组成的联合方案的临床试验已经启动。如一项评价talimogene laherparepvec和pembrolizumab联合方案效果的III期试验将在2018年完成。
其他多个靶向药物联合方案也已进入后期开发阶段。BRAF–MEK抑制剂联合方案继续用于黑色素瘤的治疗,而新的激素靶向药物组合则用于治疗前列腺癌。血管生成抑制剂阿斯利康(cediranib)单药治疗结果有好有坏,该药与ADP-ribose多聚酶(PARP)抑制剂olaparib(Lynparza;阿斯利康)联合治疗卵巢癌的临床试验正在进行中。治疗性疫苗也已进入后期开发阶段。
到2014年,抗肿瘤市场规模预计将翻一番。值得注意的是,所预测的非何杰金氏淋巴瘤,多发性骨髓瘤和乳腺癌的市场规模差不多,而非何杰金氏淋巴瘤和多发性骨髓瘤的发病率只有乳腺癌的四分之一和十分之一,这也反应出lenalidomide,bortezomib和B细胞靶向抗体利妥昔单抗rituximab在市场上取得的成功。虽然靶向药物单药治疗对于开发者们已经设定了有效性标杆,而具有协同作用的联合方案有望实质性地提高治疗效果,并使之区别于单药治疗,从而增加在市场上的竞争优势。此外,开发联合方案也可节省开发者的成本。如果能获得批准,那影响联合方案市场竞争力的一个重要因素则是价格。而预测性生物标记物的使用也是影响联合方案市场的重要因素。
(编译作者:樊小军)